
發布于 2024-04-28 16:18:18
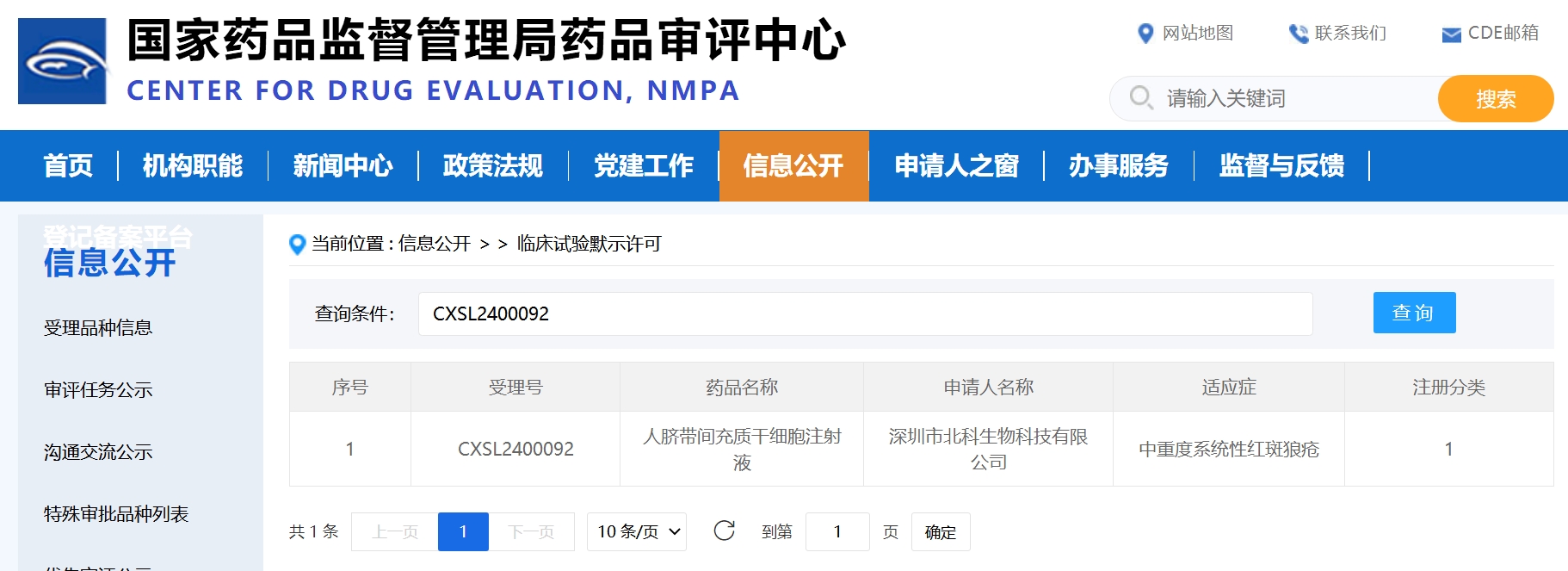
2024年4月28日,由北科生物自主研發的用于治療中重度系統性紅斑狼瘡的創新性細胞藥物“人臍帶間充質干細胞注射液”(受理號為:CXSL2400092),提前三個工作日獲得國家藥品監督管理局藥品審評中心(NMPA)的藥物臨床試驗批準通知(通知書編號:2024LP01052)。這一創新成果標志著國內首個治療中重度系統性紅斑狼瘡的間充質干細胞藥物即將進入臨床試驗階段。
系統性紅斑狼瘡(Systemic Lupus Erythematosus,SLE) 是一種全身多器官、 系統受累的自身免疫病, 以免疫細胞激活、 大量自身抗體產生為典型特征, 與遺傳、 環境和雌激素等潛在相關。目前, 糖皮質激素和免疫抑制劑治療是SLE主要治療方案, 但大部分患者難以獲得臨床緩解, 病死率高。尋找更加優化的SLE治療策略仍是目前亟待解決的難題[1]。間充質干細胞( MSC) 是源自于早期發育中胚層的成體干細胞,具有高度增殖、自我更新能力,多向分化潛能,受損組織修復功能和免疫抑制能力。研究表明 MSC 可以通過調節免疫細胞來抑制系統性紅斑狼瘡( SLE) 活性和分化為多個細胞,修復 SLE 引起的多系統和多器官損害,為近年來研究的熱點[2]。
本次北科生物提交的干細胞新藥“人臍帶間充質干細胞注射液”是北科生物自主研發的干細胞制劑,臨床擬用于治療中重度系統性紅斑狼瘡。
北科生物在深耕細胞領域近19年的基礎上,自2009年起便全面啟動了間充質干細胞的系統化研究與新藥開發。至今,公司已累計10余年的工藝開發、質量研究和穩定性數據。在此期間,北科生物完成了多項體外模型的藥效、藥理研究與安全性研究,并與眾多醫院合作開展了IIT臨床研究。公司不僅實現了臨床級、標準化及規模化的干細胞生產制備,并通過了中國食品藥品檢定研究院(簡稱“中檢院”)的全面質量檢測。在最新的藥學研究與評價技術指導原則(試行)及相關GMP指南的引導下,北科生物對本次申報的干細胞新藥進行了全面的生產工藝升級,包括無血清及無異源培養體系的優化、密閉式規模化操作等。同時,公司開發了一系列與細胞安全性及有效性緊密相關的全面檢測方法,并成功研發行業領先的下一代干細胞制備技術,申報并獲批了多項發明專利。
作為專業從事戰略性新興產業生物治療技術臨床轉化及技術服務的國家高新技術企業,北科生物一直堅持把促進創新科技成果轉化作為驅動企業發展的重要動力,創建了多個創新型性研發平臺及研發管線正在全速推進。未來,北科生物將會持續推進新藥研發,在自身免疫性疾病等更多適應癥方面申報干細胞新藥,加快相關技術產品轉化和臨床應用,打造更多自主知識產權的創新產品與解決方案,為改善人類健康不懈努力。
參考文獻:
[1]楊春娟,楊晶涵,張麗麗等.間充質干細胞在系統性紅斑狼瘡的免疫調節作用及應用[J].中華臨床免疫和變態反應雜志,2021,15(06):684-689.
[2]鞏小凡,賀穎,方明紅等.間充質干細胞治療系統性紅斑狼瘡的研究進展[J].吉林醫藥學院學報,2020,41(05):363-365.DOI:10.13845/j.cnki.issn1673-2995.2020.05.020.